Валентні стани атомів елементів
Тема: Валентні стани атомів елементів
https://history.vn.ua/pidruchniki/yaroshenko-chemistry-11-class-2019-standard-level/3.php
https://www.youtube.com/watch?v=AAO1J7Vd2Ls
https://www.youtube.com/watch?v=XF0Clcy7FLA&t=41s
Валентність — це здатність атомів утворювати хімічні зв'язки з певною кількістю інших атомів.

https://www.youtube.com/watch?v=AAO1J7Vd2Ls
https://www.youtube.com/watch?v=XF0Clcy7FLA&t=41s
Валентність — це здатність атомів утворювати хімічні зв'язки з певною кількістю інших атомів.
Постійну валентність мають:

Більшість хімічних елементів мають змінну
валентність. Наводимо її значення для
деяких з них:
Pb Плюмбум (IV група)
— II, IV;
P Фосфор (V група)
— III, V;
S Сульфур (VI група)
— II, IV, VI;
Cr Хром (VI група) — II, III, VI;
Cl Хлор (VII група) — I, III, V, VII;
Mn Манган (VII
група) — II, IV, VI, VII;
Fe Ферум (VIII група) — II, III, VI.
Валентними електронами називають електрони,
які беруть участь в утворенні хімічних зв'язків.
Ступінь
окиснення — це умовний заряд атома в
сполуці, обчислений на основі припущення, що вона складається з йонів.
Ступінь окиснення може набувати позитивного,
негативного та нульового значень.
У простих речовинах валентність і
ступінь окиснення хімічних елементів не збігаються. Наприклад, у молекулі кисню
О2 валентність Оксигену ІІ, а ступінь окиснення 0.
Визначаючи ступені окиснення елементів у
бінарних сполуках, послуговуються рядом електронегативності. Елементи з більшим
значенням електронегативності мають від'ємні значення ступенів окиснення.
ЗБУДЖЕНИЙ
СТАН АТОМА. Це поняття пов'язане зі
здатністю електронів отримувати додаткові порції енергії або віддавати її
частину.
Що ближче до ядра розміщений енергетичний рівень, то меншим запасом
енергії наділені його електрони. Тобто електрони другого рівня характеризуються
меншою енергією, ніж третього; третього — меншою, ніж четвертого і так далі. У
межах свого стійкого енергетичного рівня, електрон не виділяє і не поглинає
енергії.
Отримавши додатковий запас енергії, наприклад під час нагрівання,
електрони переходять на вищий енергетичний підрівень, атом набуває збудженого
стану. Щоб відрізняти збуджений стан атома від основного, символ елемента
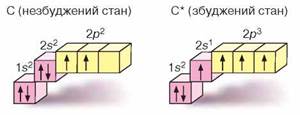
записують зі значком *. Розглянемо це на прикладі Карбону.

Наведені зображення доводять, що атом Карбону може мати два валентні
стани. В одному з них (основному) в атома Карбону два неспарених електрони, і це
визначає його мінімальну валентність ІІ та ступінь окиснення +2. У другому
стані (збудженому) неспарених електронів чотири. За рахунок них Карбон утворює
чотири спільні електронні пари з іншими атомами — набуває чотиривалентного
стану і має ступінь окиснення +4 або -4:
Здатність електронів переходити на інші енергетичні підрівні зумовлює
наявність в атомів одного хімічного елемента кількох ступенів окиснення.
ОСОБЛИВОСТІ БУДОВИ АТОМІВ НЕМЕТАЛІЧНИХ
ЕЛЕМЕНТІВ, ЩО ЗУМОВЛЮЮТЬ ХІМІЧНІ ВЛАСТИВОСТІ НЕМЕТАЛІВ. З вивченого в основній
школі ви знаєте, що вища валентність хімічних елементів груп А дорівнює номеру
групи, проте існують винятки. Наприклад, Оксиген розташований у VI групі, проте ніколи не буває шестивалентним. Елемент
цієї ж підгрупи Сульфур має сполуки, у яких він шестивалентний, наприклад
сульфур(VI) оксид SO3. Поряд з цим
існує сульфур(IV) оксид SO2 з чотиривалентним Сульфуром і гідроген сульфід H2S, у якому
валентність Сульфуру дорівнює двом.

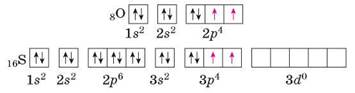
Графічні електронні формули атомів Оксигену й Сульфуру свідчать, що в
атома Оксигену відсутні вільні енергетичні комірки, тому він не може перейти в
збуджений стан і мати більше двох неспарених (валентних) електронів. Для атома
Сульфуру це цілком реально, тому що в нього є вільні комірки на d-підрівні третього енергетичного рівня. Поглинувши
додатково енергію, спарені s- і р-електрони
атома Сульфуру займають вільні комірки на d-підрівні. У збудженому стані графічні електронні
формули Сульфуру такі:

Тобто, на відміну від Оксигену, з яким Сульфур входить до однієї
підгрупи, електрони зовнішнього енергетичного рівня атома Сульфуру можуть стати
неспареними й атом Сульфуру розширює свої валентні можливості.
Атоми неметалічних хімічних елементів можуть переходити в збуджений
стан, якщо мають на зовнішньому енергетичному рівні вільні енергетичні комірки,
збільшуючи цим самим кількість неспарених електронів.
МОЖЛИВІ СТУПЕНІ ОКИСНЕННЯ НЕМЕТАЛІЧНИХ
ЕЛЕМЕНТІВ 2-го І 3-го ПЕРІОДІВ. В елементів зі змінною валентністю кількість
неспарених електронів в основному стані визначає мінімальну валентність атомів,
у збудженому стані — проміжні й максимальну (вищу) валентності. Вища
(максимальна) валентність здебільшого збігається з номером групи хімічного
елемента. Розглянута інформація дає змогу визначити ступені окиснення, яких
можуть набувати ті чи інші елементи.
Попрацюйте групами
Щойно ви з’ясували валентні стани Карбону, Оксигену й Сульфуру. Окрім
них, у 2-му і 3-му періодах розташовані Бор, Нітроген, Флуор, Неон, Силіцій,
Фосфор, Хлор, Аргон. Усі вони розташовані в головних підгрупах, а в атомах
елементів головних підгруп валентні електрони розташовані на зовнішньому
енергетичному рівні.
Завдання 1. З’ясуйте можливі валентні
стани Флуору та Фосфору. Для цього складіть електронні та графічні електронні
формули атомів цих елементів, розгляньте можливість переходу валентних
електронів на більш віддалені від ядра атома енергетичні підрівні.
Завдання 2. Напишіть формули сполук : а)
Флуору з Оксигеном, Флуору з Гідрогеном; б) Фосфору з Оксигеном, Фосфору з
Гідрогеном, що відповідають можливим валентним станам їх атомів, зазначте
ступені окиснення.
Знаємо, розуміємо
1. Завдяки чому атоми одного хімічного
елемента можуть мати різні валентні стани?
2. Поясніть, що називають ступенем
окиснення.
3. Про що свідчить той факт, що Ферум
утворює сполуки зі ступенями окиснення +2, +3 і навіть може мати ступінь
окиснення +6?
Застосовуємо
1. Серед наведених електронних формул
атомів укажіть, яка належить атому, що перебуває у збудженому стані.
a)
14Si 1s22s22p63s13p3;
б)
14Si 1s22s22p63s23p2.
2.
Складіть хімічні рівняння взаємодії:
а)
силіцію з киснем;
б) силіцію з воднем;
в) цинку з хлором;
г) фосфору з хлором.
Визначте ступені окиснення елементів у
них.
3. Який з хімічних елементів — Флуор чи
Фосфор — має лише один валентний стан? Поясніть чому.
4. Укажіть рядок, у якому записані
електронні формули одного й того самого атома в основному і збудженому станах.
А
1s22s22p63s23p4 і 1s22s22p63s23p5
Б
1s22s22p1 і 1s22s22p2
В
1s22s22p5 і 1s22s22p6
Г
1s22s22p2 і 1s22s12p3


Коментарі
Дописати коментар