33 група
Домашнє завдання: параграф 52, здати проекти
І варіант
І рівень.
1.Під час хімічних реакцій метали:
а) віддають електрони зовнішнього енергетичного рівня
б) приєднують електрони на зовнішній енергетичний рівень
в) не змінюють зовнішній енергетичний рівень.
2. Найбільшу електро- та теплопровідність має метал:
а) Са б) Ag в) Al
3. Укажіть рівняння можливої хімічної реакції:
а) Mg + Pb(NO3)2
→ б)
Ag + Cu(NO3)2 →
в) Zn + Mg(NO3)2
→
4. Укажіть окисник в реакції Ca + H2O → Ca(OH)2
+H2:
а) Са б) Н2 в) Н2О
5. Які солі зумовлюють жорсткість води:
а) гідрокарбонати Са та Мg б)
карбонати Са та Мg в) силікати
6. Грунт кислий, якщо значення рН:
а) 6,3 – 7,3 б) 5,4 – 5,7 в) > 7,3.
ІІ рівень.
7. Сполуки яких металів мають амфотерні властивості:
а) Na б) Ca в) Al
г) Fe2+ г) Fe3+.
8. Якісною реакцією на сульфат-аніон є взаємодія з:
а) Ag+ б) Ва2+ в) NH4+
9. Макроелемент, нестача якого в ґрунті призводить до
уповільнення росту надземної
вегетативної частини сільськогосподарських рослин:
а) Р б) Mg в) Zn г) N ?
ІІІ рівень.
10. Складіть рівняння реакцій за схемою перетворень:
Fe → Fe(OH)2
→ Fe(OH)3 → Fe2O3 → FeCl3 → Fe(OH)3
↓
KFeO2
11. Взаємодією одновалентного металу масою 9,2 г з водою одержали водень об’ємом
4,48л (н.у.). Визначте метал.
ІV рівень.
12. Обчисліть об’єм водню (н.у.), що виділиться в
результаті взаємодії з водою калію масою 78 г, що містить 10% домішок.
а) 22, 4 л
б) 20,16 л в) 44,8 л
ІІ варіант
І рівень.
1.Метали реагують з розчином солі, якщо:
а) до складу солі входить більш активний метал
б) до складу солі входить метал такої ж активності
в) метал-реагент активніший за той, що входить до складу солі
2. Сплави складаються: а) тільки з
металів б) з металів та неметалів
в) тільки з неметалів.
3. До легких металів належать: а) Li, Na, Al б) Fe,
Cu,
Ag
в) Zn, Pb, Au.
4. Укажіть неможливу реакцію: а) ZnCl2+
Cu →
б) Na
+H2O → в) Al + S →
5. Метали в
хімічних реакціях виступають переважно:
а) окисниками
б) відновниками
6. Пісок є сировиною для: а) легкої промисловості
б) силікатної промисловості в) глиноземного комбінату.
ІІ рівень.
7. Якісною реакцією на йон амонію є:
а) Cl- б) OH-
в)
CO32-
8. Які сполуки мають амфотерні властивості?
а) Са(ОН)2
б)Fe2O3 в) Fe(OH)2 г) Al(OH)3
9.
Укажіть відновник у
реакції: 2Fe
+ 3Br2 → 2FeBr3
а) Fe3+ б) Fe в) Br2
ІІІ рівень
10. Запишіть рівняння реакцій за допомогою яких можна
здійснити перетворення:
СаСО3 → СаО → Са(ОН)2 → СаСО3
↓
Са
11. Внасліідок взаємодії двовалентного металу масою 12г з водою виділився водень об’ємом 6,72л (н.у.). Визначте метал.
ІV рівень.
12. Обчисліть масу мангану, яку можна одержати в
результаті відновлення 200г манган (ІV) оксиду, що містить 7% домішок,
алюмотермічним способом.
а) 145 г б)
117,6 г в) 157 г.
Домашнє завдання: опрацювати відео і параграф 51 підручника
- Сприяти розвитку «атомної економіки» (що означає максимізувати ефективність виробництва, щоб дало змогу, при створенні кінцевого продукту, виробленню меншої кількості шкідливих речовин).
- Синтезувати менш небезпечні хімічні речовини.
- Розробляти безпечні, не шкідливі речовини.
- В хімічних процесах використовувати безпечні розчинники та допоміжні речовини.
- Розробити енергозберігаючі хіміко-технологічні процеси.
- Використовувати поновлювальні джерела сировини.
- Уникнути або ж зменшити виробництво похідних речовин.
- Використовуйте каталізатори, оскільки більшість із них менше потребують матеріалів для виробництва.
- Диверсифікація шкідливих речовин, які розбиваються на нешкідливі продукти після їх використання.
- Сприяти проведенню аналізу, перш ніж виробляти небезпечні речовини.
- Сприяти розвитку безпечної хімії (використання безпечних форм речовин), щоб запобігти виникненню отруєння.
Біологія 02.04.22
Тема: Генна інженерія людини: досягнення і ризики
Тестові завдання:
Питання №1
Основні галузі біотехнології:
А) клітинна і генетична інженерія Б) генетична інженерія
В) клітинна інженерія Г) клітинна і генетична інженерія
Питання №2
Суть генетичної інженерії полягає в:
А)штучному
створенні генів із потрібними
властивостями і введення їх у відповідну
клітину
Б)використанні генів із потрібними
властивостями і введення їх у відповідну
клітину
В) в перенесенні гена за допомогою
молекули РНК
Питання №3
Сукупність прийомів, методів і технологій виділення генів з
організму чи клітини або їхній
синтез поза організмами, здійснення маніпуляцій з такими
генами та введення їх в інші
клітини займається галузь...
А) біотехнологія Б) генна інженерія
В) селекція Г) біоніка
Питання №4
Введення чужорідного генетичного матеріалу в організм або
клітину називається...
А) транскрипція Б) трансформація
В) транслокація Г) трансляція
Питання №5
Трансгенні організми отримують шляхом використання методів:
А) щеплення Б) клітинної інженерії
В) генної інженерії
Питання №6
Наукові дослідження в галузі генної інженерії людини, на
відміну від таких же досліджень із
тваринами чи рослинами, мають обмеження не тільки в плані
можливостей технологічних, але
й етичних. Чим це пояснюється:
Генетична інженерія
01.04.2022 2/2 vseosvita.ua
А)Можливістю створення організму із
непередбачуваними і не завжди
корисними властивостями.
Б)Небажанням допомогти тільки одній
людині, а інших людей із такими ж
проблемами залишити осторонь.
В)Неможливістю використати гени інших
організмів для виправлення помилок у
геномі людини.
Г) Небажанням втручатися в геном
людини.
Питання №7
ГМО отримують за допомогою
А) клітинної інженерії Б) генної інженерії
В) генної терапії Г) трансплантація
Питання №8
Практичне застосування результатів генної інженерії
А) в медецині Б) в селекції
В) в металургії Г) в будівельній справі
Питання №9
Які переваги генетично модифікованих організмів над тими, що
не є результатами втручання
генних інженерів:
А) Вони не мають жодних переваг. Б) Вони часто є стійкими до
шкідників чи
паразитів.
В) Вони мають більш привабливий вигляд. Г) Вони не можуть
використовуватися для
відгодівлі тварин
Питання №10
Генна інженерія передбачає створення:
А)Організмів, які утворюються при
поєднанні матеріалу соматичних клітин
двох різних видів.
Б)Генів із новими, наперед заданими
властивостями, та введення їх у клітину
для подальшого дослідження.
В) Нових генів, що складаються із інших
речовин, ніж ті, що є сьогодні в природі. Г) Нових клітин із органелами, які не зустрічаються у природі.
Біологія 01.04.22
Тема: Застосування методів генної та клітинної інженерії в сучасній селекції
Біологія 30.03.22
Тема:Вавилов В. І. та його вчення про центри різноманітності та походження культурних рослин
Дом.завд.:Підготувати інформацію про породи тварин і сорти рослин свого регіону
Біологія 29.03.22
Тема:Сучасні методи селекції тварин, рослин і мікроорганізмів
Основними методами селекції є добір, гібридизація, штучний мутагенез і поліплоїдизація.
- Добір - метод відбору й збереження особин з певними, цінними для людини ознаками і сприяння їхньому розмноженню. У селекції застосовують масовий (за фенотипом) та індивідуальний (за генотипом) форми добору.
- Гібридизація - це метод одержання нащадків внаслідок поєднання генетичного матеріалу різних клітин або організмів. Схрещування можливе як у межах одного виду (внутрішньовидова гібридизація, що буває спорідненою й неспорідненою), так і між особинами різних видів (міжвидова гібридизація).
- Індукований мутагенез - метод штучного одержання мутацій, зумовлений спрямованою дією різних мутагенів. У контрольованих умовах цим шляхом можна отримати мутації, що трапляються в природі зрідка або взагалі не виявляються.
- Поліплоїдизація - метод отримання організмів зі збільшеною кількістю хромосом, що кратна гаплоїдному набору. Метод застосовують у селекції рослин для підвищення врожайності, подолання стерильності гібридів та ін. А якими є нові пріоритети й методи в селекції?
Хімія 29.03.22
Тема:Роль хімії у розвитку нових напрямів технологій
Відео переглянути, записати короткий конспект
Біологія 26.03.22
Тема: Завдання та досягнення сучасної селекції. Внесок вітчизняних вчених-селекціонерів
Домашнє завдання:відео переглянути, зміст слайдів записати в зошити. Підготувати інформацію про вчених-селекціонерів
Хімія 26.03.22
Тема: Роль хімії у створенні нових матеріалів
Біологія 23.03.22
Тема: Поняття про екологічне мислення. Узагальнення знань з
теми" Сталий розвиток та раціональне природокористування""
Перевіірка знань з теми «Сталий розвиток та раціональне природокористування»
1. Надходження в навколишнє середовище речовин та енергії, що призводить до порушення структури й функцій біосистем – це:
|
А)
якість довкілля; |
Б)
забруднення довкілля; |
В) охорона довкілля.2 |
2. До
механічних забруднювачів довкілля належать:
|
А)
пластмасові вироби, скло, цегла; В)
нафтове та фармакологічне; |
Б)
теплове, радіаційне, електромагнітне; Г)
зоогенне, фіто генне, мікробіогенне, генетичне. |
3.
Діяльність із застосуванням специфічних методів для передбачення можливих змін
довкілля – це:
|
А)
екологічне прогнозування; |
Б)
екологічне нормування; |
В)
екологічна експертиза. |
4. До міжнародно-глобальної екополітики
належать:
А)
політика екологічного району або міста;
Б)
прийняття і реалізація природоохоронних законів, міжнародні договори;
В)
встановлення квот на вилучення природних ресурсів, введення заборони на
скидання речовин;
Г)
створення прикордонних заповідників.
5.
Перелік видів рослин і тварин, які зникли з лиця Землі, починаючи з 1600 року –
це:
|
А)
Зелена книга; |
Б)
Чорний список видів; |
В)
Червона книга. |
6. Встановіть
відповідність між глобальними екологічними проблемами та їх наслідками для
людства:
|
1.
Деградація земель
|
А.
негативно впливають на здоров’я людини, виробництво продовольства, безпеку та
доступність ресурсів |
|
2.
Зміни глобального клімату |
Б.
втрата генетичного фонду |
|
3.
Скорочення біорізноманіття |
В.
мають вплив на вразливі людські спільноти, особливо на найбідніші |
|
|
Г.
зменшує продуктивність сільського господарства |
|
4.
Загроза продовольчій безпеці |
Д.
різке зменшення рибних запасів |
7. Встановіть відповідність
між забруднювачами довкілля:
|
1.
Хімічне забруднення атмосфери |
А.
бактеріальні добрива, поява нових мікроорганізмів, поширення алергенних видів
рослин |
|
2.
Фізичне забруднення гідросфери |
Б.
пилуваті або газуваті речовини, що можуть вступати в хімічні реакції |
|
3. Біологічне
забруднення літосфери |
В.
пестициди, мінеральні добрива |
|
|
Г.
тепло та радіонукліди |
8.
Встановіть відповідність між видами, занесеними до Червоної книги, та їх
критеріями:
|
1.
Рідкісні |
А.
види, про які відомо, що вони можуть належати до категорії зникаючих,
вразливих або рідкісних, але їх ще не віднесено до неї |
|
2. Неоцінені |
Б.
види, які у найближчому майбутньому буде віднесено до категорії зникаючих,
якщо триватиме дія чинників, що негативно впливають на їхній стан |
|
|
В.
види, які зникли в природі, але збереглися у створених умовах |
|
3.
Зниклі
|
Г.
види, популяції яких невеликі й на даний час не належать до категорії
зникаючих або вразливих, хоча їм загрожує небезпека |
|
4.
Вразливі |
Д.
види, про які після неодноразових пошуків, немає будь-якої інформації про їх
наявність у природі або в спеціально створених умовах |
9. Наслідки забруднення
гідросфери:
10. Причини деградації біорізноманіття:
Домашнє завдання: Підготувати проекти з даної темиХімія 22.03.22
Тема: Хімія і прогрес людства
ХІМІЯ В ЖИТТІ СУСПІЛЬСТВА
Протягом
усього свого розвитку, з давніх-давен і донині, хімія завжди слугувала і
продовжує слугувати людині та її практичній діяльності.
Ще
в стародавні часи, задовго до Різдва Христового, людина спостерігала в природі
хімічні явища і намагалася використовувати їх для покращення умов свого
існування. Скисання молока, бродіння солодкого соку плодів, дія отруйних рослин
привертали увагу людини.
Минув
час, і людина почала використовувати вогонь. Ніхто не знає ні місця, ні часу,
коли вона навчилася запалювати дерево і підтримувати горіння. Невідомо також,
скільки часу минуло відтоді, як людина почала використовувати вогонь для
приготування їжі, у гончарному виробництві, для обробки й виплавляння металів.
Проте відомо, що ще у стародавньому Єгипті виникли ремесла, в основі яких
лежали хімічні процеси.
Єгиптяни
добували фарби і косметичні засоби з мінеральних речовин, уміли фарбувати
тканини, виготовляти скло, кераміку, порцеляну, добувати золото, бронзу,
залізо, мідь і до сконало володіли технікою обробки металів.
Навіть
у наші дні мистецтво золотих справ майстрів давнини викликає захоплення.
У
середні віки великого поширення набула алхімія. Головне завдання її зводилося
до пошуків «філософського каменя» — містичної речовини, яка нібито має здатність неблагородні метали
перетворювати на золото, повертати людям молодість і здоров'я.
Проте й у алхіміків були значні прогресивні здобутки, пов'язані
з використанням хімії на благо людини. До них можна віднести відкриття низки
речовин (фосфору, стибію, селітри сульфатної, хлоридної, нітратної та фосфатної
кислот) і розробку методик багатьох операцій (фільтрування, перегонка речовин
тощо), які швидко знайшли практичне застосування.
Період
ятрохімії, що настав у XVI—XVIII століттях, характеризується намаганням
поставити хімію на службу медицині. Засновник ятрохімії Теофраст Парацельс
(1493—1541) твердив, що справжнє покликання хімії не у добуванні золота, а у
виготовленні ліків. Ятрохіміки розглядали хвороби як порушення хімічної
рівноваги в організмі й шукали хімічні засоби їх лікування. Відтоді головною
метою хімії стає пошук і створення лікувальних препаратів.
Про
значення сучасної хімії для людини та її практичної діяльності нема чого й
говорити, її роль у житті суспільства звичайно велика. У наш час без розвитку
хімії неможливий розвиток паливно-енергетичного комплексу, металургії,
транспорту, зв'язку, будівництва, електроніки, сфери побуту тощо.
Хімічна
індустрія постачає промисловості й сільському господарству різні матеріали та
сировину. Це паливо, мастила, хімічні волокна, пластмаси, синтетичні каучуки,
мінеральні добрива, мийні засоби, парфуми, фармацевтичні препарати, луги,
кислоти, розчинники, вибухові речовини тощо.
Ми
переконуємося, що «широко простягає хімія руки свої у справи людські. Куди не
подивимось, куди не оглянемось, скрізь обертаються перед очима нашими успіхи ЇЇ
старанності».
Ці
слова великого російського вченого-природодослідника М. В. Ломоносова
(1711—1765), висловлені майже 250 років тому, і сьогодні не втратили свого
значення. Навпаки, вони звучать з особливою силою, оскільки у наш час роль
хімії в житті суспільства постійно зростає.
Окрім
застосування речовин і матеріалів, у різних галузях промисловості
використовуються хімічні методи, наприклад каталіз, захист металів від корозії,
обробка деталей хімічним способом тощо.
Проникнення
хімічних методів, нових речовин і нових матеріалів у основні галузі
промислового виробництва, сферу побуту, охорону здоров'я дедалі більшою мірою
забезпечує їх прогрес. Саме тому й відбувається хімізація практично всіх сфер
людської діяльності. Вона є об'єктивною закономірністю розвитку виробничих сил
суспільства.
Водночас розвиток сучасного хімічного виробництва немислимий без монтажу установок, без електроніки, вимірювальної, керівної, регулювальної техніки, наукового приладобудування, без розвитку сировинної бази та енергетичного господарства.
Дом. завдання: проекти з теми
Біологія 22.03.22
Тема: Екологічна політика в Україні
Домашнє завдання: виконану практичну в приватні повідомлення
Біологія 18.03.22
Тема: Практична робота № 3
Тема : Оцінка екологічного стану свого
регіону .
Мета : закріпити знання про способи
оцінювання екологічного стану , докладно ознайомитись з екологічною ситуацією у
своєму регіоні .
Хід дослідження
Завдання 1.
Визначте можливі джерела забруднення довкілля ( атмосфери , грунту , води ) у вашому місті чи селі
Завдання 2.
Визначте , які фактори середовища у вашій місцевості сприяють розповсюдженню забруднення , що надходить від цих джерел ( наприклад вітер , течія річки , тощо ) .Заповніть таблицю :
|
Джерела забруднення |
Фактори ,
що сприяють розповсюдженню забруднення |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Завдання 3 .Зосередивши свою
увагу на об’єктах , які на вашу думку , можуть забруднювати
навколишнє середовище міста , доопрацюйте подану Вам таблицю :
|
Об’єкти -
забруднювачі |
Вид
забруднення |
Наслідки
забруднення |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Висновок :
1. Виберіть із запропонованих термінів зайвий та обгрунтуйте свій вибір : енергозбереження , захоронення відходів , зменшення викидів вуглекислого газу , переробка відходів , раціональне природокористування , сталий розвиток .
2. Сформулюйте й запишіть власне бачення способів вирішення екологічних проблем вашого регіону .
3.
Висловіть власну позицію щодо результативності
екологічної політики в Україні .
Хімія 18.03.22
Біологія 16.03.22
Тема: Антропічний вплив на біорізноманіття. Проблеми акліматизації та реакліматизації видів. Збереження біорізноманіття як необхідна умова стабільності біосфери.
Все живе на Землі постійно розвивається і взаємодіє. Ми, люди, є невід'ємною частиною живої природи і всіляко від неї залежимо. Вона служить джерелом продуктів харчування та ліків, постачає кисень, необхідний нам для дихання, та інші хімічні елементи, з яких складається наш організм. За день на свої потреби людство використовує всередньму більш як 40000 біологічних видів. Всі види, що живуть на Землі, складають разом складну систему – біосферу.
Багато вчених, які займаються вивченням біосфери, вважають, що їй загрожує небезпека. По оцінкам багатьох вчених, в найближчі 75 років з лиця Землі може зникнути половина всіх видів рослин і тварин. Дехто стурбований тим, що швидкість зникнення окремих видів може в 10000 раз перевищувати швидкість їх так названого природного зникнення. На думку одного спеціаліста, зараз кожні 10 – 20 хвилин на планеті в середньому зникає один вид. В наш час головною причиною зменшення біорізноманіття стала діяльність людини. Деякі вчені називають людину " знищувачем живої природи ".
Всі форми життя на Землі складають одну взаємопов'язану систему, яка включає в себе також елементи неживої природи. Живі організми залежать від таких складових навколишнього середовища, як атмосфера, океани, джерела прісної води, різноманітні грунти та гірські породи. Ця єдина біологічна система називається біосферою, і людина є її невід'ємною частиною. Біорізноманіття охоплює всі види бактерій та інших організмів. Деякі з них, як відомо, беруть участь у важливих хімічних процесах, необхідних для нормального функціонування екосистем. Біорізноманіття включає також зелені рослини, які в процесі фотосинтезу вбирають сонячну енергію і накопичують її у вигляді вуглеводнів – основного джерела енергії для інших живих організмів, а також виділяють кисень.
Але, як не прикро, діяльність людини веде за собою катастрофічно швидке скорочення видів на Землі. Це відбувається зряду причин:
Руйнування природного середовища життя.
Це основна причина вимирання біологічних видів. Сюди включається заготовка деревини, добування корисних копалин, вирубка лісу під пасовища, будівництво дамб і автомагістралей на місці незайманих ділянок дикої природи. Екосистеми змушені "відступати", а флора і фауна, що живе в них, втрачає необхідні умови існування. Природне середовище розчленовується, руйнується і знищується. Порушуються маршрути міграцій. Генетичне різноманіття бідніє. Популяції тварин і рослин не можуть протистояти хвороробам та іншим несприятливим факторам. В наслідку біологічні види один за одним вимирають. Зникнення окремих видів може викликати цепну реакцію: руйнування одного з компонентів природного комплексу не проходить безслідно для інших його компонентів. Якщо вимирають основні види екосистеми – це пагубно впливає на більшість інших видів.
Чужорідні види.
Коли людина ввозить в будь – яку екосистему чужорідні біологічні види, вони можуть зайняти екологічні ніші, що до того належали іншим видам. Іноді чужорідні види змінюють всю екосистему настільки, що витісняють інші види, або приносять із собою такі хвороби, проти яких у них немає імунітету. Особливо часто таке спостерігається на островах, де ісконні види рослин і тварин довгий час існували ізольовано, тобто не мали справи з "прибульцями", – говорив Олександр Менеж, професор гідробіології з Ніццького університета у Франції.
Надмірна експлуатація природних ресурсів.
Деякі біологічні види гинуть саме зцієї причини. Яскравий приклад цьому – мандруючий голуб. На початку XIX століття популяція цих птахів у Північній
Америці була найчисельнішою. Коли голуби великими зграями – по міль'ярду особин в кожній – здійснювали пере-льоти, небо на декілька днів ставало темним від птахів. Але в кінці того ж століття, в результаті полювання на них, цей вид став на межі зникнення, а в вересні 1914 року в зоопарку міста Цінцінаті помер мандруючий голуб. Дещо схоже відбулося й з бізонами на рівнинах Північної Америки, де вони були повністю знищені.
Швидкий ріст населення.
В середині XIX століття чисельність населення Землі складала один міль'ярд чоловік. Через півтора століття, коли ця цифра збільшилась до шести міль'ярдів, люди стали замислюватися, що використання ними природних ресурсів перевищує допустимі норми. Населення нашої планети невпинно зростає, і з кожним роком темпи витіснення нами різних видів тварин викликає все більше тривоги.
Загроза глобального потепління.
Згідно оцінкам Міжурядової комісії з кліматичних змін, протягом останнього століття температура на Землі може підвищитися на 3,5 градуса за Цельсієм. Таке різке потепління може викликати зникнення деяких видів тварин і рослин. По даним досліджень, підвищення температури води – одна з причин загибелі коралових рифів, які слугують середовищем життя багатьох морських організмів.
За оцінками вчених підняття рівня Світового океану на один метр може призвести до затоплення великих прибережних ділянок заболочених земель, багатих різноманітною флорою та фауною. Деякі вчені вважають, що глобальне потепління викличе танення льодового покрову Гренландії та Антарктиди. А це загрожує екологічною катастрофою.
З якою швидкістю скорочується біорізноманіття? Точної відповіді на це запитання не існує. Перш за все вченим потрібно визначити загальну кількість існуючих на Землі видів. За словами еколога Джона Харті з Каліфорнійського університета в Берклі, " окрім приблизно півтора мільйона видів, яким вже дано наукові назви, на нашій планеті мешкає безліч інших видів. А всього їх на Землі, за приблизними підрахунками, від 5 до 15 мільйонів. " Підрахувати загальну кількість існуючих видів практично не реально, оскільки, як вважає біолог Ентоні Джанетес, " більшість їх зникає з лиця Землі перш, ніж їм дадуть назву та опис. " Намагаючись встановити швидкість скорочення біорізноманіття, вчені називають різні цифри, але в будь – якому випадку картина вимальовується далеко не оптимістична. " В найближчі сто років половина видів тварин і рослин на Землі, вірогідно, постане на грані вимирання ", – пише автор однієї статті. Прогнози Джона Харті ще менш втішні: " По оцінкам біологів, в результаті знищення тропічних лісів вже через 75 років з Землі зникне щонайменше половина всіх біологічних видів. "
Як зазначалося в журналі " National geographic " (" Нешнл джіогрефік "), на основі даних, отриманих біологом Стюартом Піммом з університета в Теннессі, " 11 % птахів, тобто приблизно 1100 з 10000 існуючих на планеті видів, знаходяться під загрозою вимирання, більшість з них " дотягне " в кращому випадку до кінця XXI століття." В цьому ж журналі говоритяся про: " Як повідомила група відомих ботаніків, кожен восьмий вид рослин знаходиться на грані зникнення. Під загрозою не лищевиди, що живуть на островах чи у вологих тропічних лісах, не тільки птахи і крупні ссавці – під загрозою опинились всі біологічні види, що існують на Землі. Відбувається повсякчасне масове вимирання видів. "
З точки зору відомих вчених, таке різноманіття життєво важливо. Біорізноманіття забезпечує населення Землі і предоставляє багато інших "послуг". А скільки користі людям могли б принести ще не відкриті біологічні види! Зі скороченням числа біологічних видів скорочуються і наші майбутні можливості. Разом з вимираючими видами ми, можливо, втрачаємо ліки від СНІДу чи раку, або стійкі до вірусів сільгоспкультури. Тому нам потрібно якимось чином вже зараз зупинити знищення біорізноманіття – не лише в ім'я збереження планети, а й заради самих себе. Екосистеми виконують важливі функції, без яких не можливе життя на планеті. Продукування кисню, очистка та фільтрація води, захист ґрунтів від ерозії – все це відбувається за рахунок нормального функціонування екосистем. З економічної точки зору вартість всіх цих "послуг" колосальна. За самими скромними підрахунками вона складає біля 3000 міль'ярдів доларів у рік.
Біорізноманіття – основа нашого життя, однак зараз ми зіткнулись з його катастрофічним швидким скороченням, яке причаїло у собі загрозу для всього
живого нашої планети. Сьогодні людство починає все більше визнавати важливість біорізноманіття, але в той же час воно знищує живу природу в невиданних масштабах. Занепокоєні повсякчасним збіднінням флори та фауни, представники держав та неурядових організацій прийняли Конвенцію про біорізноманіття. В цьому домовленні підкреслюється, що збереження біорізноманіття – справа всього людства. З метою поглиблення знань про біорізноманіття біології вчені зусіх країн оголосили 2001 – 2002 рік Міжнародним роком спостережень за біорізноманіттям. Біолог Дайена Уолл з Колорадського університету (США), що очолює дану програму, говорить: "Вивчення біорізноманіття відчинить перед нами багато нових можливостей: ми виявимо не відомі досі гени та хімічні речовини, які можна використовувати як в хімічния цілях, так і в цілях підвищення врожайності культур чи очищення заражених земель." Хоча в плані кардинальних змін було досягнуто деяких успіхів, восновному сили спрямовано на боротьбу із симптомами, а не на ліквідацію їх причин. Людство зараз підійшло до такого кордону, коли час вже не терпить. Рут Патрік з Філадельфійської академії природознавчих наук, кажучи про " потенційне виснаження біорізноманіття ", робить такиц висновок: " Час не чекає Негайні, рішучі дії – запорука успіху ". Щоб зупинити процес вимирання видів, людське суспільство має в корні змінити своє відношення до нашої планети та її природних ресурсів. Це не може обмежуватися одними лише діями для зниження ущерба, який ми приносимо природі, чи для його відшкодування. Проблеми збереження біорізноманіття не можливо вирішити окремо від крупно масштабних проблем соціального розвитку. Цих цілей можна досягти без кардинальних змін в людському товаристві. В книзі " Турбота про Землю " відмічається, що обережне відношення до природи враховує " зміну у поглядах, методах господарювання, а також в соціальній структурі суспільства. "
Самостійна
робота з таблицею.
Заповніть
таблицю характеристики причин деградації біорізноманіття. Поясніть, чому втрата
біологічного різноманіття є однією з глобальних екологічних проблем.
Причини деградації біорізноманіття
|
Причина |
Визначення |
Приклади |
|
Руйнування
природного середовища життя
|
|
|
|
Збільшення
частки чужорідних видів живих організмів
|
|
|
|
Надмірна
експлуатація природних ресурсів
|
|
|
|
Швидке
зростання кількості населення |
|
|
|
Загроза
глобального потепління
|
|
|
Біологія 15.03.22
Тема: Антропічний вплив на гідросферу та літосферу
Домашнє завдання: переглянути відео і підготувати проекти з даної теми
Хімія 15.03.21
Тема:Тема: Практична робота 2
«Генетичні зв’язки між неорганічними речовинами»
Варіант 1
Мета: навчитися експериментально доводити наявність генетичного
зв’язку між неорганічними речовинами на прикладі складеного фрагмента
генетичного ланцюга
Обладнання: штатив із пробірками, піпетка, газовідвідна трубка, пальник (спиртівка)
Реактиви: хлоридна
кислота , кальцій карбонат, порошок
заліза, розчин натрій або калій гідроксиду, кальцій гідроксиду, натрій хлориду,
натрій ортофосфату, арґентум (І) нітрату, кальцій хлориду, натрій карбонату
Завдання: складіть
фрагмент генетичного ланцюга з речовин у наведених переліках. Складіть план
експерименту для здійснення хімічних перетворень за цим ланцюгом. Перегляньте
відео проведення дослідів і опишіть спостереження та складіть рівняння
реакцій. Для реакцій йонного обміну
складіть молекулярне та йонно-молекулярне рівняння. Оформіть звіт, давши відповіді на питання.
Перелік 1. Мідь → купрум (ІІ) оксид → купрум(ІІ) сульфат → купрум (ІІ) гідроксид→ купрум (ІІ) нітрат
Правила безпеки:
Перегляньте відео
за посиланням https://youtu.be/BiuvThAaO18
Хід роботи
Перегляньте відео
за посиланнями та запишіть спостереження і хімічні реакції до дослідів
Перелік 1 . Запишіть фрагмент генетичного ланцюга хімічними формулами
Cu → CuO→ CuSO4→ Cu(OH)2→ Cu(NO3)2 .
Відповідно до даного генетичного ланцюга запишіть порядок
виконання експерименту. (використовуйте посилання на відео досліди)
1)
порядок виконання експерименту (записати
які дії потрібно виконати для першої ланки генетичного ланцюга)
Мідну
дротину прожарюємо в полум’ї
пальника. Мідь взаємодіє з киснем повітря, в результаті реакції окиснення
утворюється чорний наліт купрум ( II )
оксиду.
Спостереження
-
запишіть,
яку ознаку реакції ви спостерігали під час досліду;
утворення
чорного купрум (II)
оксиду в результаті реакції окиснення
-
складіть
рівняння реакцій. Для реакцій йонного
обміну складіть молекулярне та йонно-молекулярне рівняння.
2Cu +O2 =2Cuo
Висновок: Внаслідок реакції горіння міді утворюється
купрум (II) оксид.
2)
Перегляньте відео фрагмент https://cutt.ly/bygkYu0 та запишіть:
порядок виконання експерименту (записати
які дії потрібно виконати для другої ланки генетичного ланцюга)
До купрум (II)
оксиду в пробірку доливаємо розчину сульфатної кислоти і нагріваємо.
Спостереження
-
запишіть,
яку ознаку реакції ви спостерігали під час досліду;
В
результаті реакції при нагріванні утворється синій розчин
купрум
(II) сульфату
-
складіть
рівняння реакцій. Для реакцій йонного
обміну складіть молекулярне та йонно-молекулярне рівняння.
CuO + H2SO4 =
CuSO4 + H2O
CuO + 2H+ + SO42- → Cu2+ + SO42- + H2O
CuO
+ 2H+ → Cu2+ + H2O
Висновок: В результаті взаємодії оксиду з кислотою утворилась сіль
купрум (II) сульфат та вода.
3)
Перегляньте відео фрагмент https://cutt.ly/AygluO8 та
запишіть:
порядок виконання експерименту (записати
які дії потрібно виконати для третьої ланки генетичного ланцюга)
До розчину купрум (II) сульфату доливаємо розчину лугу натрій гідроксиду
Спостереження
-
запишіть,
яку ознаку реакції ви спостерігали під час досліду;
Випадання
осаду купрум (II) гідроксиду
-
складіть
рівняння реакцій. Для реакцій йонного
обміну складіть молекулярне та йонно-молекулярне рівняння.
CuSO4 + 2NaOH
→ Na2SO4 + Cu(OH)2↓
Cu2+
+ SO42- + 2Na+ + 2OH- → 2Na+ +SO42-
+ Cu(OH)2↓
Cu2+ + 2OH- → Cu(OH)2↓
Висновок: Внаслідок реакції йонного обміну утворюється четверта
речовина генетичного ланцюга купрум (II)
гідроксид.
4)
порядок виконання експерименту (записати
які дії потрібно виконати для четвертої ланки генетичного ланцюга)
В
пробірку з осадом доливаємо розчину нітратної кислоти
Спостереження
-
запишіть,
яку ознаку реакції ви спостерігали під час досліду;
Розчинення
осаду
-
складіть
рівняння реакцій. Для реакцій йонного
обміну складіть молекулярне
та йонно-молекулярне рівняння.
Cu(OH)2↓ +2НNO3
→ Cu(NO3)2 +
2H2O
Cu(OH)2↓ +2H+
+ 2NO3- → Cu2+ + 2NO3-
+2H2O
Cu(OH)2↓ + 2H+
→ Cu2+ +2H2O
Висновок: Кінцева ланка ланцюга перетворень купрум (II) нітрат- розчинна сіль
Підбийте підсумки роботи. У процесі виконання практичної
роботи ми навчилися: експериментально виконувати
реакції, що ілюструють генетичні зв’язки між класами неорганічних сполук,
доводити взаємозв’язок між речовинами.
На чому ґрунтується можливість складання ланцюга
перетворень для
ілюстрації генетичних зв’язків між класами сполук?
Ланцюги перетворень складаємо на основі знань про
хімічні властивості неорганічних речовин, які підтверджують спорідненість між
класами.
При складанні інструкції використано Зошит для
лабораторних та практичних робіт О.В. Григорович та І. І. Черевань видавництва
Ранок
Хімія 21.01.21
Тема: Хімічна рівновага. Принцип Ле Шательє
«Хімія (рівень стандарту)» підручник для 11 класу закладів загальної середньої освіти Ярошенко О. Г.
Домашнє завдання: §39,40 К.Задорожний Біологія і екологія 10 клас
Хімія 14.01.21
Тема: Хімічні реакції. Необоротні і оборотні хімічні процеси
«Хімія (рівень стандарту)» підручник для 11 класу закладів загальної середньої освіти Ярошенко О. Г.
Біологія 14.01.21
Тема: Адаптивні біологічні ритми організмів
Домашнє завдання: §35 К.Задорожний Біологія і екологія 10 клас
Біологія 12.11.20
Тема: Токсичні речовини та їх вплив на організм. Нейрогуморальна регуляція процесів метаболізму
Домашнє завдання: Параграф 23,24, опрац. таблиці ст.102
Біологія 09.11.20
Тема: Раціональне харчування - основа нормального обміну речовин
Домашнє завдання: Параграф 22
Хімія 09.11.20
Тема: Йонний хімічний зв'язок
Домашнє завдання: параграф 5, впр.2,3, ст. 31
Бііологія 05.11.20
Тема: Вітаміни, їх роль в обміні речовин
Домашнє завдання: Параграф 20, проекти
Тема: Роль ферментів у забезпеченні процесів метаболізму
Домашнє завдання: Параграф 19
Біологія 02.11.20
Тема: Структури клітин, які забезпечують процеси метаболізму
Домашнє завдання: Параграф 16,17
Хімія 02.11.20
Тема: Донорно-акцепторний механізм утворення ковалентного зв'язку
https://www.youtube.com/watch?v=AnLzqSh0HTU
Домашнє завдання: Параграф 6, впр. 1-5, ст. 37
Хімія 26.10.20.
Тема: Ковалентний хімічний зв'язок
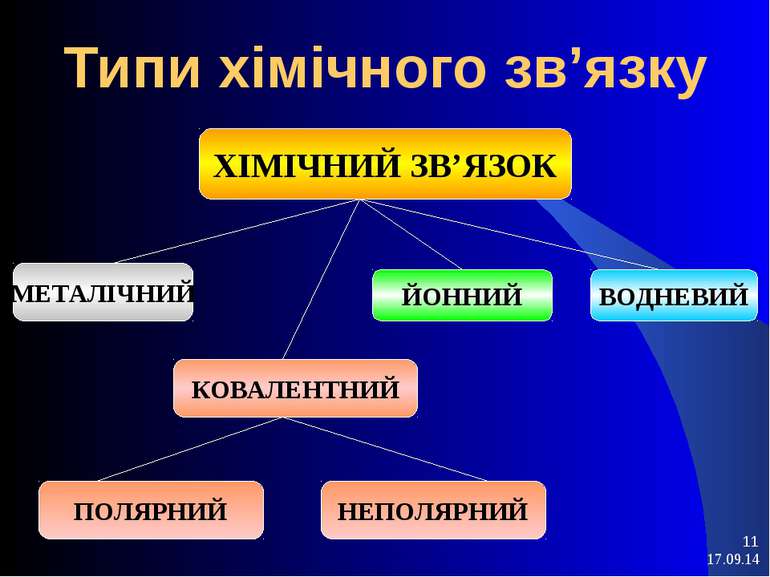
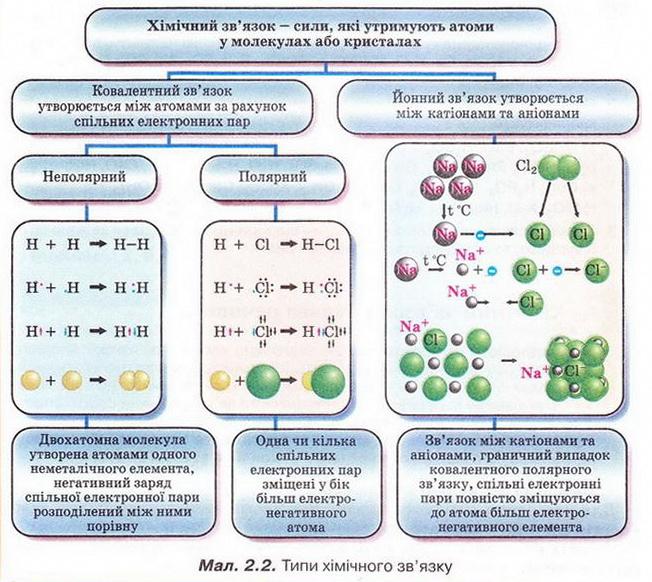
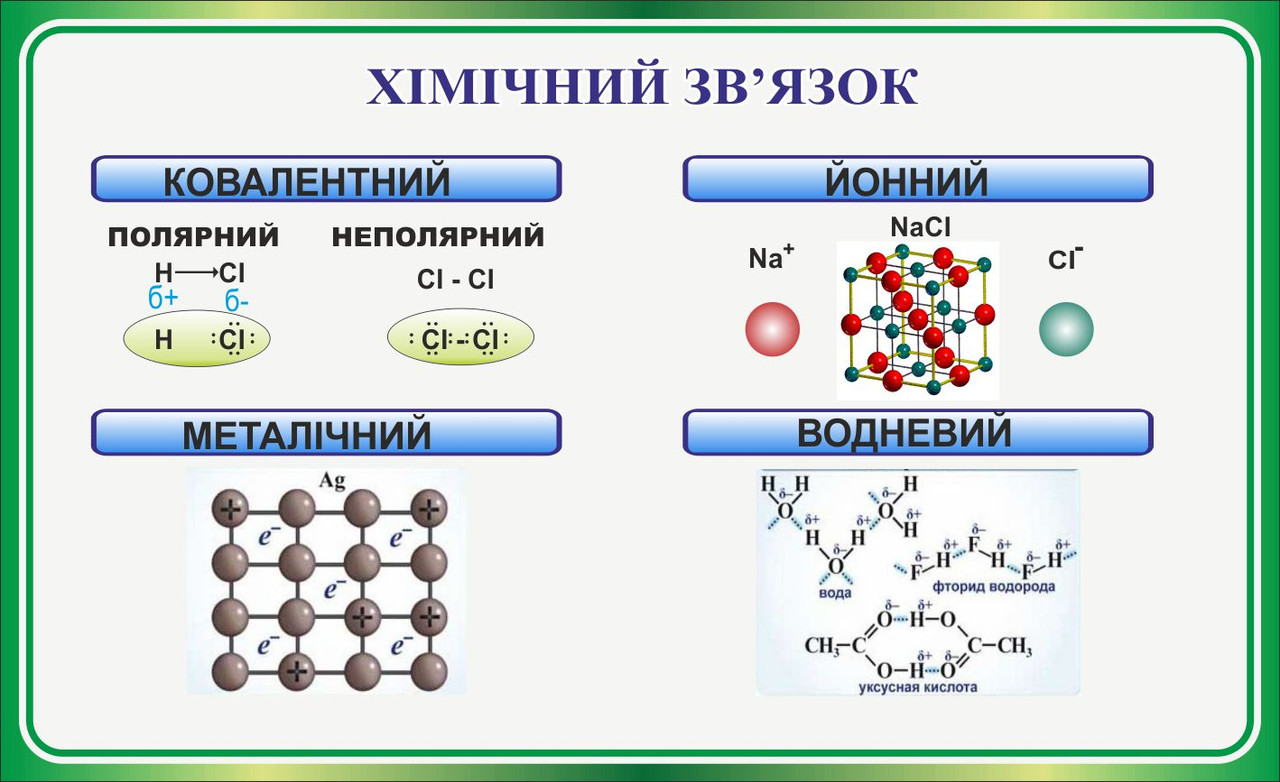
Основні типи хімічного зв'язку
Вам відомо, що атоми можуть з'єднуватися один з одним з утворенням як простих, так і складних речовин. При цьому утворюються різного типу хімічні зв'язки: іонна, ковалентний (неполярні і полярна), металева і воднева.
Одне з найбільш істотних властивостей атомів елементів, що визначають, який зв'язок утворюється між ними - іонна або ковалентний, - це електронегативність, тобто здатність атомів у сполуці притягувати до себе електрони.
Умовну кількісну оцінку електронегативності дає шкала відносних електроотріцательностей.
У періодах спостерігається загальна тенденція зростання електроотріца-ності елементів, а в групах - їх падіння. Елементи по електроот-ріцательностям розташовують у ряд, на підставі якого можна порівняти електронегативності елементів, що знаходяться в різних періодах.
Тип хімічного зв'язку залежить від того, наскільки велика різниця значень електроотріцательностей з'єднуються атомів елементів. Чим більше відрізняються по електронегативності атоми елементів, що утворюють зв'язок, тим хімічна зв'язок полярності.
Провести різку межу між типами хімічних зв'язків не можна. У більшості з'єднань тип хімічного зв'язку виявляється проміжним; наприклад, сильнополярная ковалентний хімічний зв'язок близька до іонної зв'язку. В залежності від того, до якого з граничних випадків ближче за своїм характером хімічна зв'язок, її відносять або до іонній, або до ковалентного полярного зв'язку.
Іонний зв'язок
Іонний зв'язок утворюється при взаємодії атомів, які різко відрізняються один від одного по електронегативності. Наприклад, типові метали літій (Li), натрій (Na), калій (K), кальцій (Ca), стронцій (Sr), барій (Ba) утворюють іонну зв'язок з типовими неметалами, в основному з галогенами.
Крім галогенідів лужних металів, іонний зв'язок також утворюється в таких з'єднаннях, як луги та солі. Наприклад, в гідроксиді натрію (NaOH) і сульфат натрію (Na2SO4) іонні зв'язки існують тільки між атомами натрію і кисню (решта зв'язку - ковалентні полярні).
Ковалентний неполярний зв'язок.При взаємодії атомів з однаковою електроотріца-ності утворюються молекули з ковалентним неполярний зв'язком. Такий зв'язок існує в молекулах наступних простих речовин: H2, F2, Cl2, O2, N2. Хімічні зв'язки в цих газах утворені за допомогою загальних електронних пар, тобто при перекривання відповідних електронних хмар, зумовленому електронно-ядерною взаємодій-наслідком, які здійснює при зближенні атомів.
Складаючи електронні формули речовин, слід пам'ятати, що кожна загальна електронна пара - це умовне зображення підвищеної електронної щільності, виникає внаслідок перекривання відповідних електронних хмар.
Ковалентний полярний зв'язок
При взаємодії атомів, значення електроотрецательностей яких відрізняються, але не різко, відбувається зміщення загальної електронної пари до більш електронегативного атома. Це найбільш поширений тип хімічного зв'язку, якої зустрічається як в неорганічних, так і органічних сполуках.
До ковалентним зв'язкам в повній мірі відносяться і ті зв'язки, які утворені по донорно-акцепторним механізмом, наприклад в іонах гідроксонію і амонія.
Металевий зв'язок
Зв'язок, що утворюється в результаті взаємодії відносите-льно вільних електронів з іонами металів, називаються металевої зв'язком. Цей тип зв'язку характерний для простих речовин-металів.
Сутність процесу освіти металевої зв'язку полягає в наступному: атоми металів легко віддають валентні електрони і перетворюються на позитивні заряджені іони. Щодо свобо-дние електрони, що відірвалися від атома, переміщаються між положи-тільних іонами металів. Між ними виникає металева зв'язок, тобто Електрони як би цементують позитивні іони кристал-вої решітки металів.
Водневий зв'язок
Зв'язок, який утворюється між атомів водню однієї молекули і атомом сильно електронегативного елемента (O, N, F) іншої молекули, називається водневим зв'язком.
Може виникнути питання: чому саме водень утворює таку специфічну хімічну зв'язок?
Це пояснюється тим, що атомний радіус водню дуже малий. Крім того, при зсуві або повній віддачі свого єдиного електрона водень набуває порівняно високий позитивний заряд, за рахунок якого водень однієї молекули взаємодіє з атомами електронегативних елементів, мають частковий негативний заряд, що виходить до складу інших молекул (HF, H2 ¬ O, NH3).
Розглянемо деякі приклади. Зазвичай ми зображуємо склад води хімічною формулою H2O. Однак це не зовсім точно. Правильніше було б склад води позначати формулою (H2O) n, де n = 2,3,4 і т. д. Це пояснюється тим, що окремі молекули води пов'язані між собою за допомогою водневих зв'язків.
Водневий зв'язок прийнято позначати точками. Вона набагато більш слабка, ніж іонна чи ковалентная зв'язок, але більш сильна, ніж звичайне міжмолекулярної взаємодії.
Наявність водневих зв'язків пояснює збільшення об'єму води при пониженні температури. Це пов'язано з тим, що при зниженні температури відбувається зміцнення молекул і тому зменшується щільність їх «упаковки».
При вивченні органічної хімії виникало і таке питання: чому температури кипіння спиртів набагато вище, ніж відповідних вуглеводнів? Пояснюється це тим, що між молекулами спиртів теж утворюються водневі зв'язки.
Підвищення температури кипіння спиртів відбувається також всле-дствіе укрупнення їх молекул.
Водневий зв'язок характерна і для багатьох інших органічних сполук (фенолів, карбонових кислот та ін.) З курсів органічної хімії і загальної біології вам відомо, що наявністю водневого зв'язку пояснюється вторинна структура білків, будова подвійної спіралі ДНК, тобто явище компліментарності.
Д.з. параграф 5, завд.2-4
Хімія 19.10.20
Тема: Валентнні стани елементів
https://history.vn.ua/pidruchniki/yaroshenko-chemistry-11-class-2019-standard-level/3.php
https://www.youtube.com/watch?v=AAO1J7Vd2Ls
https://www.youtube.com/watch?v=XF0Clcy7FLA&t=41s
Валентність — це здатність атомів утворювати хімічні зв'язки з певною кількістю інших атомів.

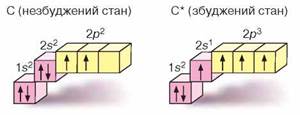
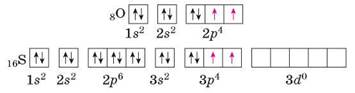

Г 1s22s22p2 і 1s22s12p3
Хімія 21.09.20
Тема: Періодична система Д.І.Менделєєва
https://www.youtube.com/watch?v=ZuvG_YihtcU https://history.vn.ua/pidruchniki/yaroshenko-chemistry-11-class-2019-standard-level/1.php
https://history.vn.ua/pidruchniki/yaroshenko-chemistry-11-class-2019-standard-level/1.php
https://history.vn.ua/pidruchniki/yaroshenko-chemistry-11-class-2019-standard-level/2.php
Біологія 21.09.20.
Тема уроку: Віруси. Особливості їх організації та функціонування.
https://www.youtube.com/watch?v=sgHeU9XUMV4
https://www.youtube.com/watch?v=oul2i_oISHs
https://www.youtube.com/watch?v=k-Zzh6xU0w0
Мета.
Освітня: формувати в учнів знання про віруси як неклітинні форми життя та внутрішньоклітинні паразити; розглянути особливості будови, життєві цикли та різноманітність вірусів,
Розвиваюча: розвивати уміння учнів порівнювати неклітинні та клітинні форми життя, робити відповідні висновки та узагальнення.
Виховна: виховувати бережливе ставлення до свого здоров’я та оточуючих людей.
Тип уроку: засвоєння нових знань.
Ключові компетентності: спілкування державною мовою, наукове розуміння природи, здатність до пошуку нових знань
Міжпредметні зв ́язки: історія, медицина, екологія.
Матеріали та обладнання: таблиці, електронні зображення
ХІД УРОКУ
І. Організація групи
ІІ. Актуалізація опорних знань
- Які властивості мають живі організми?
- Що є елементарною структурною і функціональною одиницею живого?
- Чому клітини є відкритими біологічними системами?
- Чи можуть існувати організми, яким властива тільки одна властивість із всіх властивостей живого?
ІІI. Мотивація навчально]діяльності учнів.
Проблемне запитання.
Чи може живий організм бути отрутою?
VІ. Вивчення нового матеріалу.
Ми знаємо, що живі організми – це комплекси із складних органічних сполук. Їхнє тіло складається із однієї або багатьох клітин, що функціонально взаємодіють і утворюють єдине ціле. Але в процесі еволюції з’явились структури, що складаються з нуклеїнової кислоти і білкової молекули. Вони можуть перебувати поза клітиною, не виявляючи жодних властивостей живого. Потрапляючи в клітину, ці структури використовують її органели і молекули для здійснення процесу власного розмноження. Нові частини, опинившись у навколишньому середовищі, знову не виявляють жодних властивостей живого. Такими організмами є віруси. Вони становлять окреме царство живої природи – царство Віра – Vira, що означає – отрута.
Повідомлення учнів. (Випереджувальні завдання)
Про історію відкриття вірусів, про науку вірусологію.
Після відкриття вірусів Д.Івановським, вчених тривалий час вони не привертали до уваги із-за труднощів у вивченні. Але успіхи молекулярної біології привели до того, що таємниці вірусів було відкрито.
Гіпотези походження вірусів:
1. Гіпотеза регресивної еволюції – віруси виникли з клітин, які втратили більшість органел.
2. Гіпотеза паралельної еволюції – віруси виникли в прадавні часи незалежно від клітин, використовуючи їхні можливості для перетворення енергії та синтезу білків.
3. Гіпотеза «скажених генів», висунута Джеймсом Уотсоном, твердить про те, що віруси як ділянки спадкового матеріалу клітин набули здатність існувати самостійно.
На сьогоднішній день не отримано переконливих доказів на підтримку чи спростування жодної гіпотези.
Розповідь вчителя, повідомлення учнів з використанням слайдів про будову вірусів, про поділ на прості та складні віруси.
На основі багаторічних досліджень визначені такі властивості вірусів:
- неклітинна будова;
- облігатний паразитизм у прокаріотичних та еукаріотичних клітинах, тобто паразит здатний жити лише в певних умовах;
- використання органел клітини-хазяїна для синтезу нових вірусних частин;
- відсутність власного обміну речовин;
- відсутність проявів життєдіяльності поза клітиною-хазяїном;
- відсутність росту;
- здатність до кристалізації.
Багато властивостей вірусів не притаманні іншим організмам. Ще одна важлива відмінність вірусів від клітин полягає в їхньому унікальному способі утворювати віріони внаслідок самозбирання, утворюючи симетричні структури. Залежно від виду вірусу, вібріони можуть мати ікосаедричний, спіральний або змішаний типи симетрії.
Поза клітинами живих організмів, тобто у зовнішньому середовищі, віруси перебувають у вигляді окремих часток – віріонів.
Всі віруси здатні здійснювати процес синтезу молекул ДНК на молекулах РНК. У них для цього є спеціальний фермент – ревертаза. Такого ферменту жодні живі клітини не мають.
Складання схеми «Життєвий цикл вірусів»

Робота з роздатковим матеріалом за розділами:
- віруси рослин;
- віруси тварин;
- віруси людини;
- віруси бактерій – бактеріофаги.
V. Узагальнення та систематизація знань.
Віруси, як і всі живі організми побудовані з органічних речовин, вони можуть вступати у симбіотичний зв’язок – паразитизм, їм також властиві спадковість і мінливість. Як і всі живі об’єкти, віруси здатні до розмноження, генетичної мінливості, адаптації до умов навколишнього середовища. Все це свідчить про належність вірусів до живої частини біосфери.
VІ. Підведення підсумків уроку.
VІІ. Домашнє завдання. 1. Параграф 5.К.М.Задорожний «Біологія і екологія» 10 клас рівень стандарту; 2. повідомлення, проекти «Вірусні захворювання рослин, тварин, людини»
Тема уроку: Роль вірусів в еволюції організмів, природі та житті людини.
Мета.
Освітня: формування в учнів знань про неклітинні форми життя на прикладі значення вірусів у природі та житті людини; ознайомити із різноманітністю вірусних інфекцій людини і тварин
Розвиваюча: розвивати уміння порівнювати віруси з іншими представниками рослинними і тваринними організмами; вміння аналізувати результати наукових дослідів.
Виховна: виховувати бережливе ставлення до власного здоров’я та оточуючих людей – здійснювати валеологічне виховання; почуття гордості за вчених-українців; сприяти формуванню дотримання основних гігієнічних норм і правил життєдіяльності.
Ключові компетентності: спілкування державною мовою, наукове розуміння природи, здатність до пошуку нових знань, дотримання здорового способу життя
Міжпредметні зв’ ́язки: історія, медицина, екологія.
Матеріали та обладнання: таблиці, електронні зображення
Тип уроку. Засвоєння нових знань.
ХІД УРОКУ
І. Організація групи
ІІ. Актуалізація опорних знань
Інтерактивна вправа «Мікрофон»
- відкриття вірусів;
- будова та властивості пріонів;
- механізми дії вірусів;
- пріонні захворювання;
- шляхи зараження пріонами;
- міри профілактики пріонних хвороб.
ІІI. Мотивація навчально-пізнавальної діяльності учнів.
Проблемна ситуація. У минулих століттях від багатьох хвороб гинули тисячі та мільйони людей, наприклад, від віспи, грипу.
1.Чим пояснити ці дані?
2.Чому не всі люди хворіють?
3.Чому після перенесення хвороби, люди більше не хворіють на таку хворобу?
4. Які заходи можна використовувати для запобігання вірусних інфекцій?
VІ. Вивчення нового матеріалу.
Віруси – організми, які викликають захворювання організмів. Їх, навіть, відносять до окремого царства. Віруси – внутрішньоклітинні паразити прокаріотів та еукаріотів. Віруси рослин не інфікують тварин і людину, і навпаки.
Пристосування вірусів до паразитизму проявляються в різноманітності способів ефективного зараження хазяїв. Збудники потрапляють через органи дихання, органи травлення, покриви тіла, слизові оболонки. Переносниками збудників є членистоногі: кліщі, комарі. Зараження можливе також при недотриманні санітарних норм при переливанні крові або хірургічних операцій, при статевих контактах, у наркоманів при використанні одного шприца. Але не завжди потрапляння вірусу до організму призводить до розвитку хвороби. Це залежить від чутливості хазяїна, стану його імунної системи, концентрації вірусних частинок та їхньої патогенності.
Повідомлення учнів про епідемії та пандемії на планеті у минулі століття.
Науку, що вивчає закономірності перебігу епідемій, тобто досліджує причини виникнення і поширення інфекційних хвороб та застосовує отримані знання для боротьби з ними, називають епідеміологією. Повідомлення учнів про Д.Заболотного та його внесок у розвиток епідеміології.
Надійного захисту від більшості вірусних хвороб поки що немає. Антибіотики не завжди діють, тому вірусні хвороби посідають основне місце – 75% в інфекційній патології людини і тварин.
Вчені доводять, що проникнувши в клітину, вірус спричиняє в ній інфекційні процеси. Розрізняють гострі та хронічні вірусні інфекції. Внаслідок гострої інфекції після розмноження вірусних частинок клітина зазвичай гине. За хронічної інфекції послідовні покоління вірусних частинок утворюються в клітині впродовж тривалого часу. За прихованої інфекції вірусні частинки з інфікованих клітин у довкілля не виходять і їх часто неможливо виявити і в самій клітині (ВІЛ, герпес). Людей із прихованою формою захворювання називають носіями інфекції.
V. Осмислення об‘єктивних зв’язків та взаємозалежностей у вивченому матеріалі.
Робота у групах з даних тем.
1. Вірусні хвороби рослин.
2. Вірусні хвороби тварин.
3. Вірусні хвороби людини.
4. Профілактика вірусних інфекцій.
VI. Узагальнення та систематизація знань.
Типи вірусних інфекцій.
1. Гострі інфекції: грип, віспа, кір, характеризуються швидким перебігом захворювання;
2. Латентні інфекції: герпес, що характеризується наявністю латентного періоду, коли вірус перебуває у стані про вірусу, тобто є частиною клітинного геному.
3. Хронічні інфекції, коли вірус постійно присутній у клітинах організму в малій кількості.
4. Повільні інфекції, за яких латентний період становить великий проміжок часу, навіть до 20 років.
Захисні реакції організму проти вірусних інфекцій.
1. У відповідь на проникнення вірусу в організмі людини і тварин виробляються антитіла білкової природи – імуноглобуліни. Вони блокують прикріпні білки вірусу й ті не здатні зв’язуватися з клітинною мембраною.
2. У відповідь на проникнення вірусу можуть вироблятися захисні білки – інтерферони, що пригнічують їх розмноження.
3. Клітинний імунітет – здатність певних видів лейкоцитів розпізнавати інфіковані вірусами клітини і знищувати їх.
4. Організм, що переніс певну вірусну інфекцію, зберігає несприйнятливість до її збудника.
VІI. Підведення підсумків уроку.
VІІI. Домашнє завдання. Параграф 6. Підготувати проекти до захисту.
19.10.20. Періодичний закон і періодична система хімічних елементів Д.І.Менделєєва
Д.з. параграф 1-4, тести ст. 22-24






































Коментарі
Дописати коментар